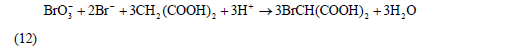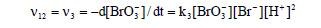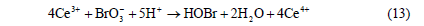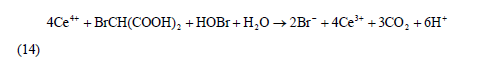摘要:本实验对CH2(COOH)2-KBrO3化学振荡体系进行研究,通过对实验条件的控制和反应物质的选取,探讨化学振荡反应的起振条件和机理,加深对振荡反应的理解和对体系远离平衡状态下的复杂行为的认识。
关键词:B-Z振荡 起振条件 振荡周期
Abstract:
In this study, B-Z chemical oscillating reaction Of CH2(COOH)2-KBrO3system was exploited to study the Chemical Oscillating Reaction. By controlling the experimental conditions and the selection of reaction materials, studying the mechanism of oscillating chemical reaction,to deepen the cognition of oscillating reactions and the understanding of the complex behavior of the system far from equilibrium state.
Keywords:
B-Z oscillating; Oscillation condition; Oscillation period;
前言
化学振荡即化学反应系统中的某些物理量随时间周期变化,是一个十分复杂的反应,包含了大量的化学反应物质,如反应物、生成物、中间体和催化剂,属于非线性动力学范畴。B-Z化学振荡是一类机理非常复杂的化学过程,Field、Koros、Noyes三位科学家经过四年的共同努力,于1972年提出**的FKN机理用来解释B-Z振荡反应的具体反应历程,随后又简化出Oregonator模型。在1921年,Bray报道了在I2-HIO3作催化剂的条件下H2O2的催化分解在某些条件下呈现出明显的振荡现象,1958年,Belousov在硫酸介质中以铈离子作催化剂用溴酸盐氧化柠檬酸出现振荡反应,1964年,Zhabotinsky报道了其它体系中时空有序的振荡现象。因而后人称他们的研究为B-Z反应。目前在许多化学系统、生物化学系统中都发现了化学振荡现象。这种现象引起了各学科工作者的浓厚兴趣。
自20世纪50年代以来,化学振荡在各个方面的应用日益广泛。1995年,Perez-Bendito D及其合作者报道了利用被测物质对化学振荡体系的脉冲扰动进行分析测定,使化学振荡现象步入了分析检测实用阶段。而后发展起来的电化学振荡更广泛地运用于理论研究和实践,如仿生学、临床医学等。此外,在食品检测与控制、环境保护等*域具有广阔的应用前景。本实验对CH2(COOH)2-KBrO3反应体系的化学振荡进行研究,通过对实验条的控制和反应物质的选取,探讨化学振荡反应的机理,加深对振荡反应的理解和对体系远离平衡状态下的复杂行为的认识。
实验部分
仪器与试剂:
0.45M丙二酸,
0.20M溴酸钾,
3M浓硫酸,4×10-3M硫酸铈铵,
蒸馏水
乳酸(分析纯),
丁二酸(分析纯),
乙二酸(分析纯),
柠檬酸(分析纯),
碘化钾(分析纯),
硫酸锰(分析纯),
硫酸铁(分析纯),
JB-1B型磁力搅拌器
上海雷磁新泾仪器有限公司;
N2000双通道色谱工作站 浙江大学智能信息工程研究所;
HS-4精密恒温浴槽 成都仪器厂
实验步骤:
1. 不同反应物加入顺序对反应的影响:
调节恒温槽使温度恒定在35°C,通恒温水于玻璃恒温夹套反应皿中,将丙二酸(10mL)、溴酸钾(10mL)、浓硫酸(10mL)、蒸馏水(10mL)、硫酸铈铵(10mL)中的三种物质先移入,开动搅拌器,恒温10分钟。再将剩下的一种物质迅速加入反应皿中,从刚加入一半**后一种试剂时开始采集数据。观察是否产生振荡,测出振荡周期和诱导时间。
2. 温度对振荡反应的影响:
固定反应物加入顺序和用量,改变体系的温度(25°C,30°C,35°C,40°C,45°C),考察其对诱导时间和振荡周期的影响。
3. 反应物浓度对振荡反应的影响:
在40°C恒温条件以及相同的加入顺序下,分别改变丙二酸、溴酸钾、浓硫酸、硫酸铈铵的浓度(体积用量按7mL,10mL,13mL,16mL变化),考察诱导时间和振荡周期的变化。
4. 反应机理的探讨:
改变反应体系的反应物,催化剂,用其它试剂替代,观察化学振荡是否依然发生,周期如何,探讨BZ振荡反应的机理。用0.45M丁二酸、0.45M乙二酸、0.45M乳酸、0.45M苹果酸、0.45M柠檬酸代替丙二酸,用0.20M碘酸钾、溴酸钠代替溴酸钾,用硫酸锰、硫酸铁溶液代替硫酸铈铵,分别进行实验,观察是否发生振荡。
注意事项:
1. 实验对溴酸钾纯度的要求很高,因此一定要冲洗干净;
2. 搅拌器磁子的位置、转速、稳定性要实时控制;
3. 在加入**后一项反应物时,注意加到一半时即开始计时;
4. 必须使
电极被溶液浸没,过程中溶液不足要加蒸馏水保证溶液体积50mL;
5. 加入前三种溶液后,要恒温7—10min,混合均匀;
6. 采集数据,峰数不能太少要5个以上。
实验结果与数据分析
实验结果:
1.实验顺序:
(每次均加入10ml去离子水)
|
加入顺序 |
一 |
二 |
三 |
四 |
|
1 |
溴酸钾 |
溴酸钾 |
硫酸 |
丙二酸 |
|
2 |
硫酸铈铵 |
硫酸 |
丙二酸 |
硫酸铈铵 |
|
3 |
硫酸 |
丙二酸 |
硫酸铈铵 |
溴酸钾 |
|
4 |
丙二酸 |
硫酸铈铵 |
溴酸钾 |
硫酸 |
|
诱导时间t/min |
3.634 |
3.607 |
3.770 |
2.630 |
|
振荡周期T/min |
0.732 |
0.727 |
0.780 |
0.796 |
#p#分页标题#e#
图像如下:
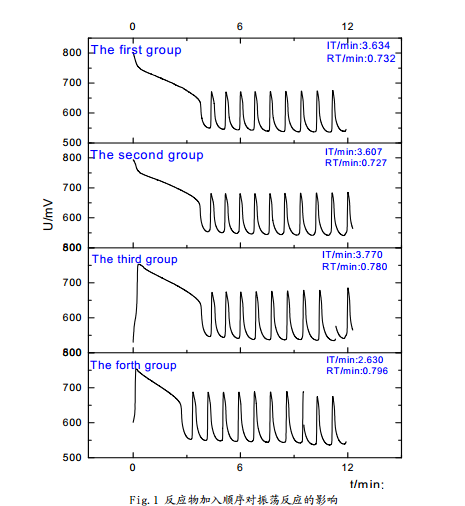
从图中可以看出:在这四种情况下,体系均可以产生化学振荡,但是诱导时间和振荡周期略有差别。其中,第二组的体系振荡周期**短,第四组的诱导周期**短。从理想的反应体系分析,振荡的发生和振荡周期应该与反应物质的加入顺序基本无关,因而基本相同,加入顺序主要会影响到反应的诱导时间,但从实验结果看,虽然四组反应振荡周期和诱导时间基本一致,但是又略有差别,忽略反应偶然因素分析认为:
四组的细微差别可以佐证四组试剂在反应体系中地位的差别,结合CH2(COOH)2-KBrO3体系的振荡反应的机理(此处仅分析FKN理论),不难解释其原因:硫酸在体系中主要提供一个酸环境,在加入前反应体系的主要参与者均已完成加入和混合,丙二酸提供的部分氢离子可以使反应极为缓慢的略有进行,并且硫酸铈铵溶液中本身含有酸成分,因此加入硫酸后所需诱导时间**短。硫酸铈铵在体系中起到催化剂作用并作为化学振荡中电子传递的媒介之一,因此**后加入时反应体系振荡周期**短。
综上,在以后的实验中将采用第二组的加入顺序进行研究,即溴酸钾、硫酸、丙二酸、硫酸铈铵。这是相对**佳的方式。
2.温度对反应的影响:
|
|
35 |
40 |
45 |
50 |
55 |
|
诱导时间/min |
4.136 |
3.066 |
2.160 |
1.630 |
1.315 |
|
振荡周期/min |
0.828 |
0.587 |
0.415 |
0.291 |
0.208 |
图像如下:
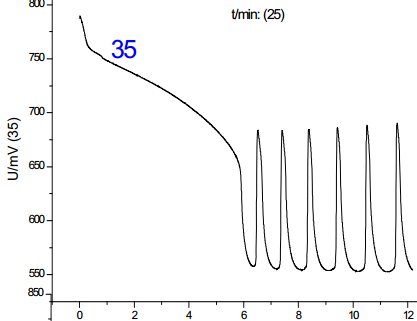
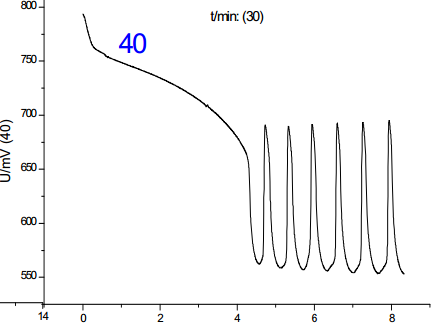
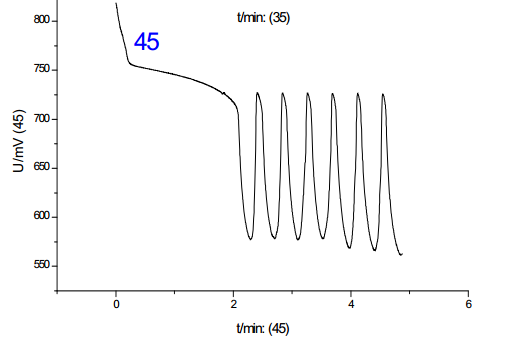
从诸图中可以看出,温度是影响振荡的一大因素,并且影响是单向的:随着温度的上升,诱导时间和振荡周期都减小;对比温度对诱导时间和振荡周期的影响,其影响程度基本一致,但考虑到其数值,温度对诱导时间的影响更大。综上,分析温度对化学振荡影响的机理,根据传统物理化学理论(阿伦尼乌斯公式)可知,温度的升高可以提高活性离子的比例,增加离子间有效碰撞几率,从而加速反应进行,此外,由于该反应催化剂为离子溶液,该反应中温度的上升有利于提高催化剂的活性,加快反应速度。但当温度提高到50-60摄氏度时,震荡周期到后来发生混乱,可见温度只有在一定范围内提高才有利于反应的进行。**佳温度约为45℃。
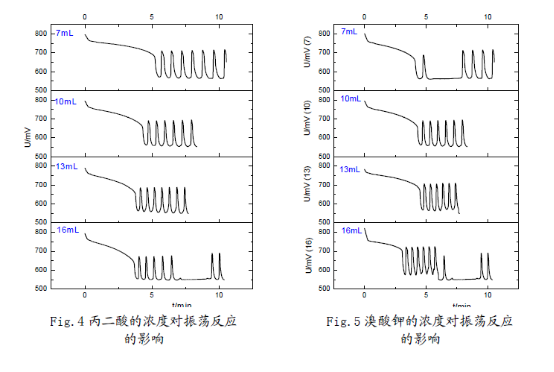
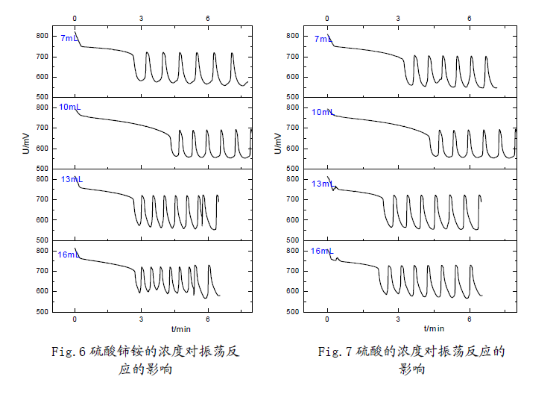
3.反应物浓度对反应的影响:
在45°C恒温条件以及与以上相同的加入顺序(蒸馏水、溴酸钾、硫酸、丙二酸、硫酸铈铵)下,分别改变丙二酸、溴酸钾、硫酸铈铵、硫酸的浓度(变化的体积用量按7mL,10mL,13mL,16mL变化,并相应的改变蒸馏水用量使反应体系总体积保持在50mL),考察诱导时间和振荡周期的变化。
做出与诱导时间、振荡周期与浓度相应的统计图如下:
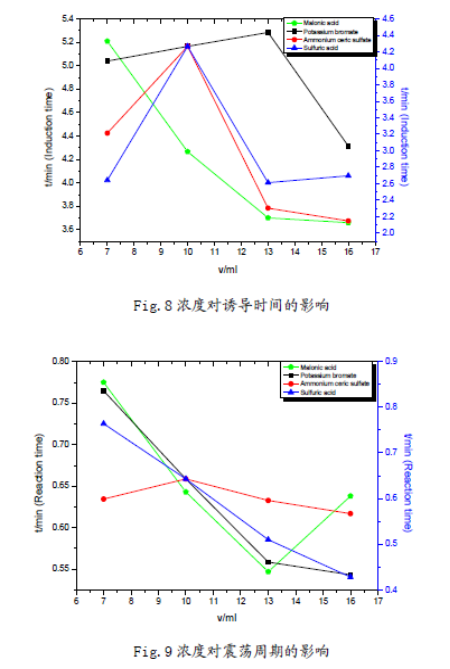
(1)在7mL—16mL范围内,丙二酸、硫酸铈铵浓度越高,化学振荡的诱导时间越短;溴酸钾浓度越大,化学振荡的诱导时间先增后降;硫酸浓度增加,化学振荡的诱导时间略有增加,但是变化幅度不大。因而可以认为,在适当浓度范围内:丙二酸、硫酸铈铵的浓度对诱导时
间有负影响;溴酸钾的浓度对诱导时间有正影响,但是其存在一个**适浓度;硫酸的浓度对诱导时间影响不大。
(2) 溴酸钾、硫酸浓度增大时,振荡周期减小,近似线性关系;丙二酸浓度增大时,振荡周期基本也呈线性下降趋势,但是在16mL时振荡周期突然升高;硫酸铈铵对化学振荡周期的影响较小,振荡周期随浓度增大先增后降,存在一个**适浓度。从硫酸铈铵的异常性,结合机理中其作为催化剂,说明该催化剂对反应影响的多重性,可能与铈离子催化反应中存在吸附极限有关。
(3) 观察分析图形可知:反应物的浓度不但影响了诱导时间和振荡周期,同时还影响了振荡的波形。浓度对振荡体系的影响是比较显著的;但浓度对振幅的影响却不大,说明浓度对振荡体系的各个参数的影响是有选择性的。这也反映出化学振荡体系本身的复杂性,及其极容易受反应环境的影响。
反应机理的探究:
改变反应体系的反应物、催化剂,用其它试剂替代,观察化学振荡是否依然发生、周期如何,探讨B—Z振荡反应的机理。#p#分页标题#e#
用0.45M丁二酸、0.45M乙二酸、0.45M柠檬酸代替丙二酸,用0.20M碘酸钾、溴酸钠代替溴酸钾,用硫酸锰、硫酸铁溶液代替硫酸铈铵,分别进行实验,观察是否发生振荡
(1) 用0.45M丁二酸、0.45M乙二酸、0.45M柠檬酸代替丙二酸后,仅有苹果酸、柠檬酸可以观察到振荡现象,乳酸没有振荡现象但是出现异常现象。
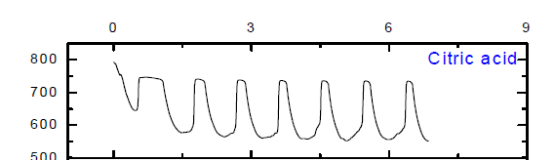
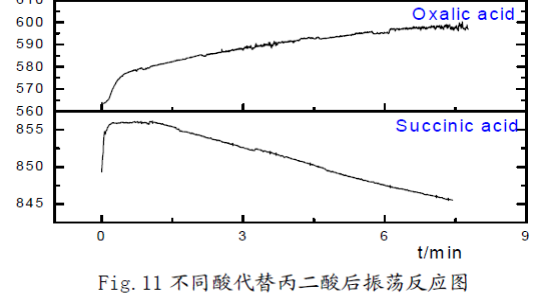
对比乙二酸与丙二酸:不可以看出仅有两个羧基,无法发生振荡反应,还必须有丙二酸中受羧基影响的活泼甲基; 对比丁二酸与丙二酸:丁二酸中有两个羧基,并且有与羧基直接相连的活泼甲基,但是仍然无法发生振荡反应,故丙二酸中活泼甲基同时受两个羧基的影响就**关重要了;对比柠檬酸与丙二酸、丁二酸可知,当有机酸分子中活泼甲基同时受到两个羧基,或者是一个羧基和一个羟基、或者是一个羧基和一个酮基的影响时,化学振荡可能可以正常发生。由于实验室没有提供丁酮二酸,无法对其进行验证实验,但是查阅资料知,丁酮二酸代替丙二酸可以使化学振荡正常.
结合CH2(COOH)2-KBrO3化学振荡体系的FKN理论可知:丙二酸中活泼甲基可以被Br2取代,产生Br-。当Br-浓度达到一定值时,BrO3-又将其氧化生成Br2,由此形成Br-的振荡。柠檬酸、苹果酸和丙二酸在体系中作还原剂,将Ce4+还原成Ce3+。由于乳酸没有活泼亚甲基,很难被Br2取代,因此无法产生Br-,观察不到振荡现象。
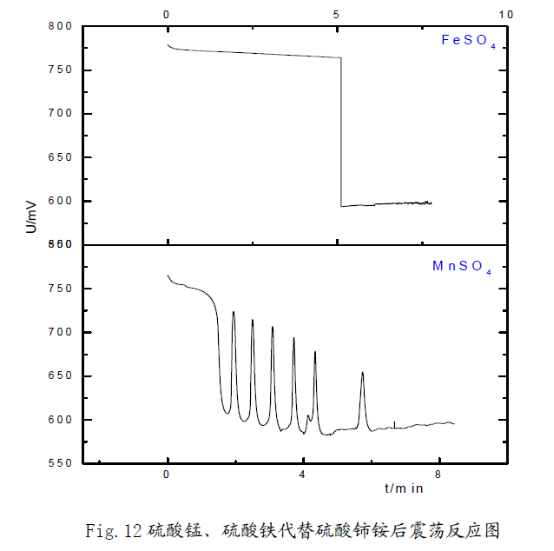
3) 用硫酸锰代替硫酸铈铵后,可以看到振荡现象,但是用硫酸铁代替硫酸铈铵,振荡反应没有发生,但是查阅资料知:Mn2+、Fe3+同样具有催化作用。在振荡体系中,锰元素存在Mn2+、Mn3+两种形式,铁元素以Fe2+、Fe3+的形式存在。

此时,浓度较大的Br2与丙二酸反应生成BrCH(COOH)2,即反应(8)。反应(8)与反应(11)构成了Br-与Br2的循环,其总体的宏观效果(简称过程A)可表示为:
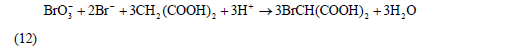
由于反应(3)是上述反应中**慢的一步,因此总反应(12)的速度由反应(3)决定,即
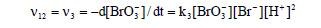
当Br-浓度较小时,占主导地位的反应为Ce3+被BrO3-氧化成Ce4+,即由反应(4)、(5)、(6)合成的第二个宏观反应(简称过程B):
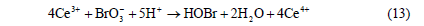
这一步总反应的反应速率由反应(5)决定。
Br-的再生可以由反应(1)、(9)、(10)合成第三个宏观反应(简称过程C):
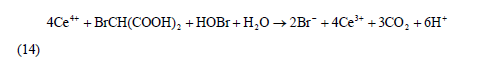
反应(12)、(13)、(14)组成了BZ振荡体系的全过程,相互联系、制约和切换。
在上述10个反应中,HBrO2具有自催化的特点,起着切换振荡过程的开关作用。
该反应机理的核心是由HBrO2实现的自催化及其相应的正反馈机制。在反应体系中,主要存在着A、B两种不同的总过程。在特定的时问或空间内,哪一种过程占优势取决于体系中溴离子的浓度。当溴离予浓度足够大时,反应按A过程进行.随着溴离子浓度的下降,反应从A过程切换到B过程,**后通过C过程使溴离子再生,因此,溴离子在振荡反应中相当于一个选择开关。金属铈离子在反应中起催化作用,催化B过程和C过程.随着振荡反应的进行,体系中的溴酸根离子逐渐减少,二氧化碳气体逸出,体系的能量与物质逐渐耗散,**终导致振荡反应的结束。
化学振荡条件的总结
(1)反应体系中应该有两个稳态存在,即具有双稳定性;
(2)反应历程中应该包含自催化的步骤,该反应中HBrO2既是产物又是反应物;
(3)反应体系远离平衡态。在封闭体系中反应会衰减,在敞开体系中可以长期持续振荡;
(4)化学反应体系复杂,应该严格控制反应体系温度、浓度、酸度、搅拌速度等。
振荡波形异常的分析
(1)实验过程中,磁力搅拌器中磁子的转动并非时持续稳定的,由于实验室实验设备的老化,实验台面的震动等因素,引起磁子不时上下跳动,旋转不稳定,对于化学振荡反应的进行及实验设备的测定带来较大影响,使振荡的波形出现小型的不稳定峰,有时甚**会引起化学振荡体系的崩溃,而使得振荡中止;
(2)恒温过程中,有微量试剂反应,带来误差;
(3)实验室使用的试剂,尤其是溴酸钾,不是现配现用,久置分解,对实验带来干扰;
(4)实验过程中出现了几次正常试剂与条件但是无法正常进行振荡反应,**后正是是由于之前同学将试剂污染引起,同理由于试剂共用,也能由于其他同学的失误将试剂污染,而带来不可知影响;
(5)化学振荡反应本身机理极为复杂,反应环境等带来的细微误差都极有可能使化学振荡出现异常甚**是崩溃,故实验中出现的较小的峰形异常,可以忽略;#p#分页标题#e#
(6)由于不可知因素带来的混沌效应等也会引起峰形异常
实验改进建议
(1)更新实验设备,做实验过程中及时对磁子位置进行调节;
(2)希望实验室及时更新实验试剂,尤其是溴酸钾等溶液;
(3)实验室应该提供更多试剂如丁酮二酸等
实验结论
B-Z振荡反应是一种典型的化学振荡反应,其本质就是在较强的酸环境中溴酸盐氧化有机物,过渡金属离子、金属络合物等作为催化剂,中间有自催化产物亚溴酸HBrO2的生成与消失。B-Z振荡反应体系中的关键组分是催化剂和有机物,极电位在1.51~1.00V之间的金属或金属络离子均可作为该体系的催化剂,还原剂的
电极电位应在1.0V以下。
B-Z振荡反应是一个非常复杂的化学反应体系,温度、浓度、酸度、搅拌速度等都可能影响振荡反应的诱导时间、振荡周期、振荡寿命、振幅,乃**振荡图形。因此,在利用振荡反应进行化学分析时应注意控制实验条件。