1 实验目的和要求 掌握碘(Iodine)量法测定(gage)溶解氧(dissolved oxygen)(Oxygen)的方法原理。
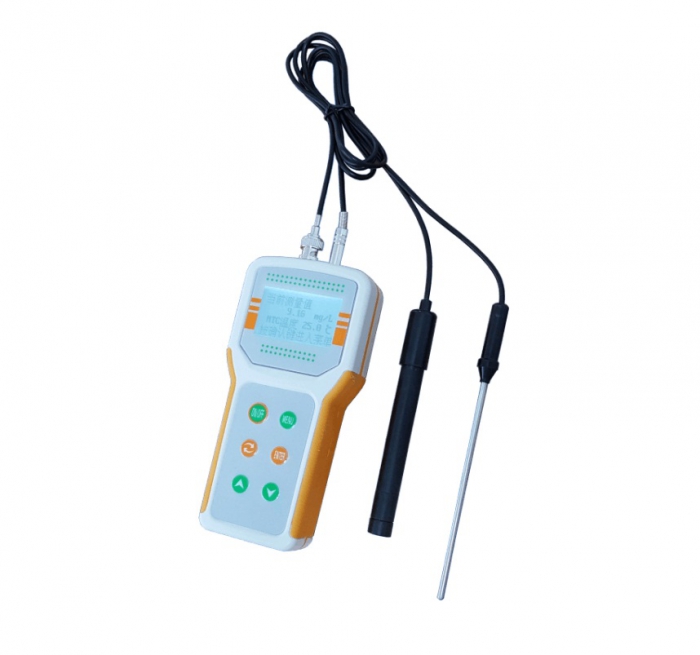
溶解氧测定仪是测定水中溶解氧的装置,工作原理是氧透过隔膜被工作
电极还原,产生与氧浓度成正比的扩散电流,通过测量此电流,得到水中溶解氧的浓度。 2 方法原理 溶解于水中的分子态氧称为溶解氧。水中溶解氧的含量与大气压力、水温及含盐量等因素(factor)有关。大气压力下降、水温升高、含盐量增加,都会导致溶解氧含量降低(reduce)。 清洁地表水溶解氧接近饱和。当有大量藻类繁殖时,溶解氧可能过饱和;当水体受到有机物质、无机物质污染(pollute)时,会使溶解氧降低,甚**趋于零,此时厌氧细菌(fungus)繁殖活跃,水质恶化。水中溶解氧低于3-4mg/L时,许多鱼类呼吸困难;继续减少,则会窒息死亡。在这种情况下,厌氧菌繁殖并活跃起来,有机物发生腐败作用,会使水源有臭味。一般规定水体中的溶解氧**少在4mg/L以上。在废水生化处理过程中,溶解氧也是一项重要控制指标。 测定水中溶解氧的方法有碘量法及其修正法和氧
电极法。清洁水可用碘量法;受污染和地面水和工业废水必须用修正的碘量法或氧
电极法。 水样中加入硫酸锰(manganese)和碱性碘化钾(Potassium),在溶解氧的作用下,生或氢氧化(oxidation)锰沉淀,此时氢氧化锰性质极不稳定,继续氧化生成锰酸。 MnCl2+2NaOH=Mn(OH)2↓+2NaCl 2Mn(OH)2↓+O2=2MnO(OH)2↓ MnO(OH)2+Mn(OH)2=2H2O+MnMnO3↓ 棕黄色沉淀,溶解氧越多,沉淀颜色越深。加酸后使已经化合的溶解氧(以MnMnO3的形式存在)与溶液中所存在的碘化钾起氧化作用而释出碘。 2KI+H2SO4(浓)=2HI+K2SO4 MnMnO3+2H2SO4(浓)+2HI=2MnSO4+I2+3H2O 以淀粉(starch)作指示剂,用硫代硫酸钠标准溶液滴定,可以计算(calculate )出水样中溶解氧含量。滴定反应如下: 2Na2S2O3+I2=Na2S4O6+2NaI
(简洁原理:水样中溶解氧(dissolved oxygen)与氯化锰和氢氧化钠(化学式:NaOH) 反应(reaction),生成高价锰棕色沉淀。
ph计是指用来测定溶液酸碱度值的仪器,是一种常见的分析仪器,广泛应用在农业、环保和工业等*域。土壤pH值是土壤重要的基本性质之一。
溶解氧测定仪是测定水中溶解氧的装置,工作原理是氧透过隔膜被工作电极还原,产生与氧浓度成正比的扩散电流,通过测量此电流,得到水中溶解氧的浓度。加酸(Acerbity)溶解后,在碘离子存在下即释出与溶解氧含量相当的游离碘,然后用硫代硫酸钠标准溶液滴定游离碘,换算溶解氧含量。) 6 3 试剂(reagent)及其配制 除另有说明,所用试剂均为分析纯,水为蒸馏(still)水(distilled water)或等效纯水。 3.1 氯化锰溶液:称取210g氯化锰(MnCl2·4H2O),溶于水,并稀释**500mL。 3.2 碱性碘化钾溶液:称取250g氢氧化钠(NaOH),在搅拌下溶于250mL水中,冷却后,加75g碘化钾(KI),稀释**500mL,盛于具橡皮塞的棕色试剂瓶中。 3.3 硫酸溶液(acid solution)(1+1):在搅拌下,将50mL浓硫酸(H2SO4,ρ=1.84g/mL)小心地加到同体积的水中,混匀。盛于试剂瓶中。 3.4 硫代硫酸钠溶液[c(Na2S2O3·5H2O)=0.01mol/L]:称取25g硫代硫酸钠(Na2S2O3·5H2O),用刚刚煮沸冷却的水溶解,加入约2g碳酸钠,移入棕色试剂瓶中,稀释**10L,混匀。置于阴凉处。 硫代硫酸钠溶液的标定: 移取10.00mL碘酸钾标准溶液(c(1/6KIO3)=0.0100mol/L),沿壁流入碘量瓶中,用少量水冲洗瓶壁,加入0.5g碘化钾,沿壁注入1.0mL硫酸溶液(1+3),塞好瓶塞,轻荡混匀,加少许水封口,在暗处放置2min。轻轻旋开瓶塞,沿壁加入50mL水,在不断振摇下,用硫代硫酸钠溶液滴定**溶液呈淡黄色,加入1mL淀粉溶液,继续滴定**溶液蓝色刚褪去为止。重复(repeat)标定,**两次滴定读数差小于0.05mL为止。按式
(1)计算(calculate )其浓度:
7 ——橡皮管:直径5~6mm,长20~30cm; ——滴定管:25或50mL,分刻度0.05mL; ——锥形烧瓶(flask):容量(Capacity)250mL; ——碘量瓶:容量250mL; ——量筒:200mL; ——棕色试剂瓶:500mL,1000mL; ——定量加液器:1mL,2个; ——移液吸管:1mL; ——一般实验室常备仪器和设备(shèbèi)。 5 分析步骤 实际实验步骤分成户外采样固定和室内分析两部分。 5.1 水样的现场采集和固定 shou先检查溶解(solubility)氧采样瓶是否漏水。然后,打开水样瓶塞,将连接有机玻璃(是一种通俗的名称、缩写为PMMA)采水器底部的橡皮管另一端插入水样瓶底部,慢慢注入待测海水(速度过快会产生气泡),直**溢出,待海水溢出水样瓶三倍体积(volume)后,抽出橡皮管,立即用定量加液器(管尖插入液面)依次序注入1.0mL氯化锰溶液和1.0mL碱性碘化钾溶液,塞紧瓶塞(瓶内不准有气泡),按住瓶盖将瓶盖上下颠倒不少于20次。避光保存,返回实验室后尽快完成其他测定(gage)步骤。 5.2 实验室测定步骤
